ПРОИЗВОДСТВО МАГНИЯ И ТИТАНА
§ 32. Производство магния
Сырьем для получения магния служат следующие материалы: карналлит MgCl₂ x KCl x 6H₂O (содержит 12 - 30% хлористого магния), магнезит MgCO₃ (свыше 45% MgO), доломит СаСО₃ x MgCO₃ (14 - 22% MgO), бишофит MgCl₂ x 6Н₂О (свыше 46% MgCl₂). Магний получают двумя способами: электролизом хлоридов и термическим восстановлением из руд.
При получении магния электролитическим способом из такого сырья, как магнезит, сначала получают хлорид магния. Для этого магнезит подвергают обжигу при температуре 850 - 900° С с целью удаления СО₂ и получения MgO. Затем хлорированием в присутствии углерода получают хлорид магния: MgO + Cl₂ + С = MgCl₂ + СО. Полученный хлорид магния подвергают электролизу.
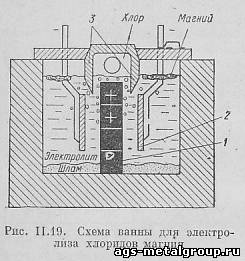
На рис. II.19 приведена принципиальная схема одной секции ванны для электролиза хлоридов магния. Ванна прямоугольной формы имеет огнеупорную футеровку. Анодом служит графитовая пластина 1, катодами - стальные пластины 2. Между анодом и катодом имеется перегородка 3 из шамотного кирпича. В каждой ванне собирают несколько секций, состоящих из анодных блоков и двух катодных пластин. Сила тока в ваннах достигает 30 000 - 50 000 а при напряжении в 7 в. Электролитом при электролизе хлористого магния служит сплав солей: 8 - 16% MgCl₂, 25 - 35% CaCl₂, 25 - 35% NaCl и 18 - 25% KCl. При электролизе MgCl₂ разлагается. Хлор выделяется на аноде, откуда он отсасывается в хлоропровод и используется для хлорирования окиси магния. На 1 т магния получается 2,9 т хлора. Магний выделяется на катоде. Так как магний легче электролита, то он всплывает и с поверхности электролита извлекается вакуумными ковшами.
Для получения магния применяют и более простые термические методы, состоящие в восстановлении магния из его соединений кремнием, углеродом и другими элементами. Эти способы позволяют использовать дешевые виды сырья и топлива.
§ 33. Производство титана
Промышленное значение имеют титаносодержащие минералы: ильменит FeO X TiO₂ (содержит до 61% TiO₂), рутил TiO₂ (около 10% окислов железа, остальное TiO₂), титанит, перовскит и др.
Особенности производства титана обусловлены его высокой химической активностью и большим сродством к кислороду, азоту, водороду и другим элементам. Титановые руды подвергаются электромагнитному, электростатическому, флотационному, гравитационному и другим видам обогащения, в результате которых получаются концентраты, содержащие до 60% TiO₂. Рациональным способом переработки железотитановых концентратов является плавка в электрических печах. Восстановительной плавкой получают чугун, легированный титаном (0,6 - 2,0% Ti), и шлаки, содержащие около 80% TiO₂ и 1,5 - 3,0% FeO, используемые в качестве сырья для получения титана.
Получение металлического титана из титановых концентратов или шлаков сводится к получению:
- тетрахлорида титана TiCl₄ представляющего собой жидкость, кипящую при 136° С;
- титановой губки восстановлением тетрахлорида титана;
- слитков компактного титана из титановой губки.
1. Получение тетрахлорида титана из рутила TiO₂ производится восстановлением углеродом и хлорированием при 800° С по реакции: TiO₂ + 2Cl₂ + 2С = TiCl₄ + 2СО.
2. Получение титановой губки производится восстановлением тетрахлорида титана магнием по реакции: TiCl₄ + 2Mg = Ti + 2MgCl₂. Процесс ведется в стальных реакторах при температуре 950 - 1000°С в атмосфере аргона или других инертных газов.
3. Получение компактного пластичного титана из губки чаще всего осуществляется плавкой в электрических дуговых или высокочастотных печах. Схема дуговой печи с расходуемым электродом приведена на рис. II.7. Плавка ведется в вакууме или в среде инертных газов. После плавки получают титан, содержащий около 0,2% примесей, отличающийся высокой пластичностью, хорошо поддающийся прокатке, ковке и штамповке.
Наиболее чистый промышленный титан, содержащий менее 0,1% примесей, получают йодидным способом - разложением иодидов титана на поверхности вольфрамовой нити, нагретой до 1300 - 1500° С в вакууме.
Особо чистый титан может быть получен из технического титана методом зонной плавки. Метод основан на явлении большей растворимости примесей в жидком металле по сравнению с растворимостью в твердом металле.
