У первого начала интересная и длинная история. Здесь, однако, излагается только конец ее.
Принцип эквивалентности между теплотой и работой. Много лиц участвовало в открытии первого начала, но мы можем остановиться только на Ю. Р. Майере (1814 - 1878) и Дж. П. Джоуле (1818 - 1889).
Майер по образованию и профессии врач. Майера поразила светлая венозная кровь у жителей острова Ява (1840). У европейцев она темная. Он объяснил это различие: вследствие высокой температуры тропиков организм должен вырабатывать меньше теплоты для покрытия ее потерь, чем при более низкой температуре в Европе. Поэтому в условиях тропиков артериальная кровь должна меньше раскисляться, чем в условиях европейского климата.
На первый взгляд может показаться, что наблюдения Майера не имеют никакого отношения к действию тепловых машин. Но это не так: Майер следовал за Лавуазье.
По Лавуазье, человеческий организм - тепловая машина. У Майера и возникла мысль: не изменится ли количество теплоты, выделенной организмом при окислении одного и того же количества пищи, если организм помимо выделения теплоты производит еще работу. Если количество теплоты не изменится, то из одного и того же количества пищи можно получать то меньшее, то большее количество теплоты. Из произведенной организмом работы снова можно получить теплоту, например трением. Если количество теплоты изменится, то у работы и теплоты один и тот же источник - окисленная в организме пища. Тогда работа и теплота могут превращаться друг в друга. Майер приходит к важнейшему для термодинамики выводу: «Теплота и движение превращаются друг в друга» - и ставит перед собой дальнейшую задачу: «Но мы не имеем еще права останавливаться на этом. Мы должны узнать, сколько требуется работы для получения определенного количества теплоты, и наоборот. Иными словами: закон неизменного количественного отношения между движением и теплотой должен быть выражен также числовым образом». Это число - отношение количества работы (выраженной в каких-то единицах) к количеству теплоты (выраженной в каких-то единицах) - называется механическим эквивалентом теплоты.
Для нахождения этой величины надо провести опыты с любой закрытой системой. Она должна совершить цикл, обмениваясь теплотой и работой с другими системами.
После окончания цикла в самой системе изменений нет и быть не может. Таким образом, система только превращает теплоту и работу друг в друга. После окончания цикла сама система выпадает из термодинамического рассмотрения. В этом удобство циклов. Но без системы невозможны превращения теплоты и работы.
Пусть никто не вздумает вычислять механический эквивалент теплоты, рассматривая некруговые процессы.
Майер вычислил (1842) механический эквивалент теплоты для цикла. Сам Майер опытов не проводил. Он воспользовался результатами работ, которые были выполнены не позже 1823 г. Вся подготовительная работа для открытия закона была закончена за 20 лет до Майера.
Не было только одного, но самого важного и необходимого - понимания смысла полученных результатов.
Закрытой системой был воздух. В начальном своем состоянии он имел давление 1 кгс/см² и температуру 0° С. Система находилась в состоянии незаторможенного внутреннего механического равновесия и незаторможенного внутреннего термического равновесия. Воздух в начальном своем состоянии занимал объем один кубический метр. Воздух находился в сосуде, герметически закрытом подвижным поршнем. Поршень передвигался без трения. Сосуд и поршень образовывали границы системы. Припишем сосуду и поршню исчезающе малую массу, стало быть, исчезающе малую общую теплоемкость.
Цикл состоял из трех стадий. Первая стадия. Понижают температуру воздуха на 1° С при постоянном давлении. Система отдает термостатам количество теплоты, равное общей теплоемкости воздуха при постоянном давлении. Подвешенный груз производит над системой работу. Ее количество вычисляют по уравнению (4). Изменение (уменьшение) объема равно, как установил еще (1802) Гей-Люссак, 1/273 первоначального объема воздуха.
Вторая стадия. Воздух в приборе Гей-Люссака расширяется до первоначального объема. Баллоны в приборе различной емкости: больший - 272/273 м³, меньший - 1/273 м³. В больший баллон помещают весь воздух, который участвовал в первой стадии, при температуре - 1° С. Меньший баллон эвакуирован. После открытия крана и перепуска воздуха с дальнейшим установлением незаторможенного внутреннего механического равновесия и такого же термического равновесия температура воздуха после расширения останется равной - 1°С.
Чтобы вычислить механический эквивалент теплоты, Майеру нужен был только результат опыта Гей-Люссака. Но Майер объяснил также этот опыт. Объемная работа при расширении газа в опыте равна нулю, по постановке самого опыта. Природа газа такова, что (см. главу 4) при адиабатическом расширении газа без совершения работы температура газа не изменяется.
Высказанное положение тем более точно, чем меньше плотность газа. Оно становится совсем точным при исчезающе малой плотности газа. Если опыт Гей-Люссака понят, то для его проведения годится уже описанный сосуд с поршнем. Надо только позаботиться об адиабатическом протекании опыта. Надо дать газу расшириться без противодействующей силы на внешней поверхности поршня. После окончания второй стадии воздух имеет температуру - 1° С и объем один кубический метр.
Третья стадия. Стопорят поршень и повышают (конечно, при постоянном объеме) температуру воздуха на 1° С, Объемная работа равна нулю. Количество же теплоты, полученной системой, равно общей теплоемкости воздуха при постоянном объеме. После окончания третьей стадии воздух имеет температуру 0° С и объем один кубический метр. Цикл закончен.
На первой стадии цикла система отдала количество теплоты, равное общей теплоемкости воздуха при постоянном давлении. На второй стадии система не получала и не отдавала теплоты - адиабатический процесс.
На третьей стадии система получила количество теплоты, равное общей теплоемкости воздуха при постоянном объеме. Суммарно в цикле система отдала теплоту. Суммарное количество отданной теплоты равно разности между теплоемкостью воздуха при постоянном давлении и теплоемкостью воздуха при постоянном объеме.
Только на первой стадии процесса объемная работа отлична от нуля. На второй стадии количество объемной работы равно нулю из-за расширения без противодействующей силы; на третьей стадии - из-за постоянства объема. На первой стадии объем воздуха уменьшился. Подвешенный груз опустился и совершил работу над системой. Суммарно: в цикле система отдала термостатам теплоту, подвешенный груз опустился и совершил работу над системой.
В распоряжении Майера были данные Делароша и Берара о теплоемкости воздуха при постоянном давлении. Теплоемкость воздуха при постоянном объеме Майер вычислил по уравнению Лапласа для скорости звука в воздухе.
Таким образом, Майер мог найти и значение механического эквивалента теплоты. Ему надо было только разделить суммарное для всего цикла количество работы, совершенной над системой, на суммарное для всего цикла количество отданной системой теплоты. Как все это остроумно и красиво!
Современные экспериментальные данные позволяют несравненно точнее вычислить значение механического эквивалента теплоты, чем это могло получиться у Майера: (суммарное количество работы в круговом процессе) : (суммарное количество теплоты в круговом процессе) = механический эквивалент теплоты = 426,6, кгс . м/Ккал...........................(9)
Уравнение (9) выражает принцип эквивалентности.
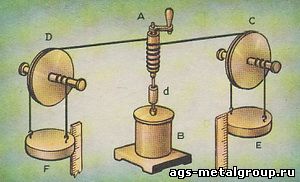
Рис. 16. Опыт Джоуля. Жидкость в сосуде В перемешивается при адиабатических условиях мешалкой Ad. Источник работы - грузы Е и F. Грузы, опускаясь, вращают мешалку. Над системой (жидкость, сосуд, мешалка) производится работа. Температура системы поднимается. Чтобы восстановить первоначальную температуру, через стенки сосуда при неподвижной мешалке передают теплоту источнику теплоты. Количество теплоты измеряют. Цикл закончен, все измерения произведены. Остается вычислить механический эквивалент теплоты.
Систематические (1843 - 1878) превосходные экспериментальные исследования Джоуля доказали постоянство механического эквивалента теплоты. Значение этой величины не зависит ни от природы системы, ни от характера цикла.
Необходимо только, как уже указывалось, чтобы система, совершая цикл, была закрытой и обменивалась с другими системами теплотой и работой.
Здесь можно описать только один опыт Джоуля. Цикл состоял из двух стадий. В первой стадии при адиабатических условиях и при постоянном атмосферном давлении над системой совершалась работа (груз опускался). Температура системы повышалась.
Во второй стадии система отдавала теплоту другим системам при постоянном внешнем давлении и принимала первоначальную температуру. Обе стадии и составляли цикл.
Джоуль не проводил второй стадии цикла. Общая теплоемкость при постоянном давлении системы была известна. Поэтому Джоуль мог вычислить количество теплоты, которую должна была отдать система, чтобы ее температура приняла первоначальное значение. Джоуль осуществлял экспериментально только первую адиабатическую стадию (рис. 16).
При повышении температуры объем системы увеличивается: система совершает объемную работу над постоянным внешним давлением (атмосфера - источник работы).
При понижении температуры объем системы уменьшается: постоянное внешнее давление производит объемную работу над системой. Но, по уравнению (4), суммарное количество объемной работы для всего цикла равно нулю. При вычислении механического эквивалента теплоты объемная работа поэтому не учитывается. Учитывается только работа опускающихся грузов.
Р. Э. Клаузиус (1822 - 1888) назвал принцип эквивалентности между работой и теплотой первым началом термодинамики.
«Во всех случаях круговых процессов, когда из теплоты появляется работа, тратится пропорциональное полученной работе количество тепла, и, наоборот, при затрате той же работы получается то же количество тепла».
Принцип эквивалентности похоронил беспочвенную надежду создать термодинамический вечный двигатель.
Принцип исключает возможность провести цикл, при котором система суммарно совершала бы работу над другими системами и суммарно не поглощала бы эквивалентного количества теплоты от других систем. Невозможность чисто механического вечного двигателя стала ясной гораздо раньше. Еще в 1775 г. Французская академия наук объявила, что она никогда больше не будет рассматривать никакой машины, дающей вечное движение. (Здесь движение в смысле работы.) Построение вечного двигателя невозможно!
Следствия из принципа эквивалентности. Суммарное количество теплоты в цикле не равно в общем случае нулю. Примеры - циклы Майера, Джоуля. Отсюда вывод: теплота не есть свойство системы. Количество теплоты, получаемой (отдаваемой) системой, зависит не только от начального и конечного состояний системы, но и от пути перехода ее из начального состояния в конечное.
После открытия принципа эквивалентности нельзя говорить, что система содержит теплоту независимо от того, вещество ли теплота или движение частиц тела. Можно говорить только, что система получает или отдает теплоту. Теплота, как и работа, не есть свойство системы.
О теплоте, как и о работе, можно говорить только в связи с процессом и во время процесса, который совершает система, но не в связи с ее состоянием. «Мы должны тщательно запомнить: мы знаем о теплоте только то, что случается, когда теплота переходит от одного тела к другому. Мы не должны предполагать, что теплота, когда она вошла в систему, существует в ней в виде теплоты» (Дж. К. Максвелл).
Теплота, как и работа, - количественная мера передачи движения от одной системы к другой, но движения уже беспорядочного. Передается теплота хаотическими движениями молекул тела, при отсутствии предпочтительного направления в движении молекул. Такова передача движения при контакте двух тел с различными температурами.
Для передачи беспорядочного движения нет необходимости даже в непосредственном контакте двух тел с различными температурами. Тела могут быть разъединены. Движение передается через вакуум беспорядочными электромагнитными волнами. В этом случае говорят о лучистой теплоте.
Работа - передача упорядоченного движения. Теплота - передача беспорядочного движения. Но для систем, состоящих из небольшого числа молекул, деление передачи на две формы теряет смысл. Изучать подобные системы методами термодинамики уже нельзя.
В передаче беспорядочного движения участвует не менее двух систем. Одна из них - это изучаемая нами система, та же, которая участвует в передаче упорядоченного движения. Вторая система, на другом конце передачи, измеряет количество теплоты. Больше ничего нас во второй системе не интересует. Название ее в отличие от изучаемой системы источник теплоты. (Раньше авторы называли его термостат.) Источниками теплоты могут быть, например, смесь воды и льда, кусок меди с определенной температурой. По изменению его температуры (зная его теплоемкость) измеряют количество переданной теплоты. Источник теплоты ее не содержит.
Источник теплоты надо понимать не в смысле источник воды, а как, скажем, химический завод источник удобрений.
Поясним теперь, как ставят термодинамический опыт. Система всегда находится внутри проведенных границ, внутри оболочки, физической или мысленной. Источник работы (в принципе одного достаточно для любого опыта) и источники теплоты (в зависимости от опыта может быть один, два, очень много источников теплоты) находятся вне границ, вне оболочки. Поэтому упорядоченное движение и беспорядочное движение всегда должны передаваться через оболочку, через границы системы. Нет передачи упорядоченного движения через границы системы, нет и работы. В опыте Гей-Люссака нет передачи упорядоченного движения через границы системы, через стенки обоих стеклянных баллонов. Количество работы в этом опыте равно нулю. В опыте Гей-Люссака нет и передачи беспорядочного движения через границы системы (из-за малой длительности опыта и плохой теплопроводности стекла). Количество теплоты в опыте Гей-Люссака равно нулю - адиабатический опыт.
При передаче движения, упорядоченного и беспорядочного, через границы системы вещество не должно переходить через границы. В противном случае невозможно измерить количество работы и количество теплоты. Понятия работы и теплоты потеряют свою ценность. Только закрытая система - предмет термодинамического изучения. К тому же ее взаимодействия с другими системами должны ограничиться передачами работы и теплоты.
Подобная система называется термодинамической системой, а процесс, совершаемый ею, - термодинамическим процессом.
Внутренняя энергия системы. Принцип эквивалентности выражается уравнением (9). Численное значение механического эквивалента теплоты зависит от произвольного выбора единиц для количества работы и количества теплоты. Но чтобы экспериментально обосновать этот принцип, необходимо измерять количество работы и количество теплоты хоть в произвольных, но независимых друг от друга единицах. После открытия принципа эквивалентности стало возможным измерять количества работы и теплоты одной и той же единицей, но снова произвольной. Сейчас работу и теплоту измеряют в джоулях. При общей единице измерения механический эквивалент теплоты равен единице: (суммарное количество работы в круговом процессе) : (суммарное количество теплоты в круговом процессе) = 1...........................(10)
Формулировку первого начала термодинамики можно теперь заменить другой, более простой (для начинающих, пожалуй, более опасной): «Во всех случаях круговых процессов, когда из теплоты появляется работа, тратится равное полученной работе количество теплоты, и, наоборот, при затрате той же работы получается то же количество теплоты» (Р. Клаузиус). В дальнейшем найдет применение только уравнение (10). Не забывать, при каком условии оно справедливо!
Запишем уравнение (10) в другом виде: (суммарное количество теплоты в круговом процессе) - (суммарное количество работы в круговом процессе) = 0............................(11)
Математическое преобразование уравнения (10) не увеличивает его физического содержания, но позволяет легче выявить это содержание. Выдающийся физик Л. де Бройль указал: «Математическое рассуждение должно установить следствия, которые уже содержатся в посылках, не будучи еще очевидными; значит, оно не может дать в своих выводах больше того, что содержится неявно в исходных гипотезах». Математическое преобразование уравнения (10) в уравнение (11) и выявило следствие: в любом термодинамическом цикле разность между суммарным количеством теплоты и суммарным количеством работы всегда равна нулю. Чем интересно это следствие? Выводом из него: если изменение величины в круговом процессе равно нулю, то величина - свойство системы. Уточним вывод. Теплота и работа связаны не с состоянием системы, а с процессом, ею совершаемым. Поэтому разность между количеством теплоты и количеством работы характеризует не само свойство системы, а только изменение свойства. Это свойство получило название внутренней энергии системы: (изменение внутренней, энергии системы при процессе) = (суммарное количество теплоты, полученной системой при этом же процессе) - (суммарное количество работы, произведенной системой при этом же процессе)............................. (12)
Уравнение (12) выражает закон сохранения и превращения энергии в применении к термодинамическим процессам. Уравнение замечательно и своей математической структурой, и своим физическим содержанием. Внутренняя энергия системы - свойство системы. Изменение внутренней энергии системы при термодинамическом процессе зависит только от начального и конечного состояний системы, а не от пути перехода ее из начального состояния в конечное. В цикле изменение внутренней энергии всегда равно нулю. Теплота и работа не числятся в свойствах системы. Количество теплоты и количество работы зависят от пути перехода системы из начального состояния в конечное, а не только от начального и конечного состояний. В цикле количество теплоты и количество работы в общем случае не равны нулю. И вот: разность двух величин, которые порознь не являются свойствами системы, равна изменению свойства системы. Интересно и важно!
Математическая структура уравнения (12) легко объясняет, почему «к 30-м годам прошлого столетия большинство сведущих ученых терзались сомнениями относительно природы теплоты». Ученые не могли понять, почему в одних несомненных опытах теплота ведет себя так, как будто бы она свойство системы, а в других, тоже безупречных, опытах не является свойством. Может ли так быть? Может! В процессах, в которых количество работы равно нулю, количество теплоты равно изменению энергии. В этих процессах количество теплоты зависит только от начального и конечного состояний системы и не зависит от пути перехода ее из начального состояния в конечное. Но это не исключительный случай, когда теплота подделывается под свойство системы. Пусть единственной формой работы при процессе будет объемная работа при постоянном давлении. Тогда, по уравнению (4), количество работы зависит только от начального и конечного состояний системы. Количество теплоты, по уравнению (12), снова зависит только от начального и конечного состояний системы. Опыты Тейлора - Рихмана, опыты Фаренгейта - Бургаве, закон Гесса - все находят объяснение. Но кто в 18 - начале 19 в. мог догадаться: проведение калориметрических измерений при постоянном (атмосферном) давлении есть то необходимое условие, при котором теплоту можно рассматривать так, как будто она свойство системы. До открытия принципа никто не мог догадаться. После открытия мог уже всякий.
Часть внутренней энергии системы зависит от температуры. Эту часть называют термической энергией системы. С изменением температуры изменяются скорости движения молекул. Вторая гипотеза о природе теплоты относится не к теплоте в современном термодинамическом смысле этого понятия, а к термической энергии.
В адиабатических процессах работа подражает свойству системы. В этих процессах, по определению, количество теплоты равно нулю и количество работы равно (с обратным знаком) изменению внутренней энергии системы. Для вдавливания поршня в воздушном огниве надо совершить работу над системой. Внутренняя (термическая) энергия системы возрастает. Повышение температуры и есть выражение возрастания внутренней энергии. Никто да не скажет, что при адиабатическом сжатии повышение температуры вызвано превращением работы в теплоту. Такое утверждение было бы полностью лишено смысла. Внутри системы нельзя говорить ни о теплоте, ни о работе.
Рассмотрим процесс, при котором суммарное количество теплоты равно нулю и суммарное количество работы равно нулю. Тогда, по уравнению (12), изменение внутренней энергии тоже равно нулю и сама внутренняя энергия остается постоянной. Закрытая система, которая не обменивается теплотой и работой с другими системами, называется изолированной системой. Внутренняя энергия изолированной системы не изменяется, остается постоянной, - закон сохранения энергии применительно к термодинамическим процессам.
Уравнение (12) часто используют при термодинамических расчетах. В опыте Гей-Люссака газ (малой плотности) расширился без изменения температуры. По постановке опыта, количества теплоты и работы равны нулю. Тогда, по уравнению (12), при изотермическом изменении объема газа ~малой плотности) изменение энергии газа равно нулю. Но изменение энергии газа при изотермическом изменении объема всегда равно нулю, а не только в опыте Гей-Люссака. Можно изотермически расширить газ с совершением работы. Тогда газ должен получить теплоту. Количество теплоты равно количеству работы. По уравнению (12), изменение энергии, конечно, равно нулю. Газ можно изотермически сжать с затратой работы. Тогда газ отдаст теплоту. Количество отданной газом теплоты снова равно количеству затраченной над газом работы. Иначе при изотермическом изменении объема изменение энергии газа не равнялось бы нулю.
Когда начальное и конечное состояния системы выбраны, можно на любом пути от начального состояния к конечному менять по своему произволу или количество теплоты, или количество работы, но не оба количества одновременно.
на этом сайте https://galychyna.org/ найдете больше полезной информации по теме
