Источники первых сведении о температуре - ощущения тепла и прохлады, жары и холода со всеми непрерывными усилениями и ослаблениями этих ощущений.
Температура как интенсивное свойство. Какие распространенные сведения важны для понимания того, что такое температура? Заполним бочку холодной водой из ведер. Сумма объемов воды в ведрах равна объему бочки. Но сколько бы холодной воды ни влить в бочку, горячей воды при этом не получится. Рассуждение это совсем не смешно и не наивно, и опыт этот не очевиден сам собой. Это очень важный закон природы. Мы к нему просто привыкли. Физика - великое торжество человеческого ума. Но она часто развивалась в связи с изучением кажущихся тривиальностей» (Д. П. Томсон).
Из нескольких коротких палок можно составить одну длинную, если соединить их между собой встык. Длина, объем - свойства системы. Но теперь добавим: длина, объем, площадь, масса - примеры экстенсивных свойств (латинское слово extensivus - протяженный). Экстенсивные величины складываются. На законе сложения этих величин основан метод их измерения. Измерение экстенсивной величины - это сравнение ее с другой, однородной с ней величиной (длины с длиной, площади с площадью, объема с объемом, массы с массой и т. д.).
Измерять температуру так, как измеряют длину, площадь, объем, массу, нельзя: температуры не складываются. Невозможна такая единица температуры, которой можно непосредственно измерять любую температуру. Температура - пример интенсивных свойств системы (латинское слово intensivus - напряженный). К температуре закон сложения неприменим. Если железный стержень разделить (мысленно) на несколько частей, температура каждой из них от этого не изменится. Длина каждой из частей изменится. Непосредственно установить числовое соотношение между различными температурами бессмысленно и невозможно. Но как же измерять температуру, если нельзя пользоваться методом, пригодным для экстенсивных величин? Задача оказалась непростой. История говорит: геометрия возникла на несколько тысяч лет раньше, чем термометрия.
Термоскоп. Выдающийся французский физиолог К. Бернар (1813 - 1878) высказал мысль: «Обычно открытием называют ознакомление с новым фактом. Но я думаю, что идея, связанная с этим фактом, составляет на самом деле открытие. Всякий экспериментальный почин заключен в идее. Она вызывает эксперимент». Запомним эту мысль. Она позволит правильно оценить изобретение термоскопа (греческое слово skopeo - смотрю) Галилеем (вероятно, в 1592 г.).
Давно была известна связь между переменой в тепловых ощущениях, которые в нас вызывает какое-нибудь тело, и изменениями самого тела. Раньше всего заметили (легче всего было заметить) изменение объема воздуха. До нас дошли описания древних приборов. Их построили Герон Александрийский (предположительно в 1 в. н. э.) и Филон из Византии (предположительно во 2 в. до н. э.). Действие этих приборов и было основано на изменениях объема воздуха при нагревании и охлаждении его.
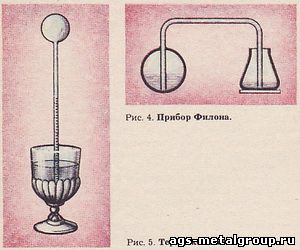
Прибор Филона (рис. 4) - это полый свинцовый шар с трубкой, доходившей до его дна. Другой конец трубки был опущен в открытый сосуд. В свинцовый шар до половины была налита вода, и над ней находился воздух. Шар выставляли на солнце. Воздух расширялся и вытеснял воду из шара. Она по трубке вытекала в открытый сосуд. Прибор ставили в тень. Воздух сжимался. Вода из сосуда снова переходила в шар.
Термоскоп Галилея (рис. 5) еще проще прибора Филона и состоял из стеклянного шарика и припаянной к нему узкой стеклянной трубки. Нагревали шарик в руках и опускали конец трубки в воду, налитую в сосуд. После охлаждения шарика вода поднималась в трубке выше уровня в сосуде. К трубке для удобства наблюдения прикрепляли шкалу с произвольно нанесенными делениями.
Термоскоп позволял качественно судить о повышении или понижении температуры по передвижениям уровня воды в трубке. Впрочем, и качественное суждение могло быть однозначным только тогда, когда при изменении температуры не изменялось атмосферное давление. Прибор простой и неточный, и все же можно без преувеличения сказать: научная термометрия и, значит, термодинамика начинаются, когда Галилей изобрел первый термоскоп. Создание термоскопа связано с гениальной идеей Галилея - судить об изменениях температуры по другим измеряемым изменениям в телах. Эта же идея сохранилась, когда от термоскопа стали переходить к термометру (греческое слово metron - мера). Идея решила все и принесла успех.
Термическое равновесие. Достаточно было термоскопа, чтобы открыть один из четырех основных законов термодинамики - закон термического равновесия. Нет возможности связать открытие этого закона с одним или даже с несколькими именами и приурочить открытие к определенной дате. Многие исследователи, которые занимались вопросами термометрии, не всегда осознавали в термическом равновесии обоснованный опытом закон и рассматривали это равновесие как очевидное явление. По сути дела, измерение температуры термоскопами (а позже термометрами) основано на законе термического равновесия.
В начале второй половины 18 в. Дж. Блек (1728 - 1799) ясно изложил закон термического равновесия с указанием условий, при которых оно может установиться: «...Все тела, которые свободно сообщаются друг с другом и не подвергаются неравенству внешних условий, принимают одну и ту же температуру. Ее указывает термоскоп. Все тела принимают температуру окружающей среды. Применение термоскопов научило нас следующему. Пусть 1000 или более различных родов материи - металлы, камни, соли, дерево, пробка, перья, шерсть, вода и ряд других жидкостей - имеют вначале различные температуры. Поместим все эти тела в комнату без окна, не освещаемую солнцем. Теплота будет передаваться от более горячих из этих тел к более холодным в течение, возможно, нескольких часов или в течение дня. По окончании этого периода приложим термоскоп последовательно к каждому телу. Показание термоскопа будет точно одним и тем же».
Блек рассмотрел пример, когда термическое равновесие установилось между различными телами. Тогда какое-нибудь другое тело (термоскоп в рассматриваемом примере), придя в термическое равновесие с одним из перечисленных тел, тем самым оказывается в термическом равновесии со всеми прочими телами. Справедливо и обратное положение. Пусть какое-нибудь тело, например термоскоп, находится в термическом равновесии с каждым из изолированных друг от друга тел. Установление контакта между телами, как в примере Блека, не вызовет в них изменений температуры. Многие до сих пор рассматривают оба положения как очевидные. Такой взгляд ошибочен. Закон термического равновесия, как и всякий закон, основан на опыте. Гениальный физик М. Планк (1858 - 1947), много сделавший и для термодинамики, указал: «То, что два тела, находясь в термическом равновесии с третьим телом, находятся и между собой в термическом равновесии, вовсе не само собой понятно, но очень замечательно и важно».
Закон термического равновесия позволяет однозначно измерять температуру термоскопами (термометрами). Термоскоп (термометр) показывает свою собственную температуру, Она равна температуре тела, с которым термоскоп (термометр) находится в термическом равновесии. В главе 1 предвосхищены результаты, описанные Блеком. Комната без окна, не освещаемая солнцем, - это термостат. После нескольких часов или дня ожидания каждое тело приходит в состояние незаторможенного внутреннего термического равновесия и в состояние внешнего термического равновесия.
Термометр. Что же предстояло сделать, чтобы превратить термоскоп в термометр? Как выполнить программу, намеченную самим Галилеем: «Измерять то, что измеряемо, и постараться сделать измеряемым то, что еще не является таковым».
Р. Бойль (1627 - 1691) писал: «Эти термоскопы, подверженные действию атмосферы различного веса, а также тепла и холода, легко могут сбивать нас с толку, если мы не будем одновременно определять другим прибором вес атмосферы». Другой прибор - это барометр. Его изобрел в 1644 г. Е. Торричелли (1608 - 1647). Сам же Бойль открыл в 1661 г. зависимость между давлением и объемом газа при постоянной температуре. Барометр и закон Бойля позволяют учитывать, как изменения в давлении воздуха влияют на показания термоскопа. Но еще лучше, чем вносить поправки на изменение давления, создать термоскоп, который не нуждается в них. Исторически так и произошло. Еще до работ Торричелли и Бойля изобрели жидкостный термометр (1631), точнее, тоже термоскоп. Показания его практически не зависели от изменения барометрического давления. Жидкостный термометр - это перевернутый прибор Галилея, заполненный вместо воздуха на первых порах водой, потом спиртом, другими жидкостями и, наконец, ртутью. Ртуть оказалась очень удобным термометрическим веществом. Один физик 18 столетия заявил в восторге: «Определенно природа создала ртуть для изготовления термометров!»
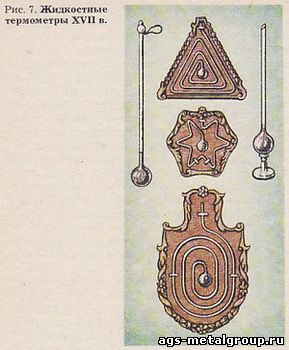
Конец термометрической трубки сначала оставляли открытым (сказалось происхождение от термоскопа Галилея), а потом стали запаивать его. Но задачи, которые надлежало решить, на этом не закончились. Надо было выразить показания термоскопа, т. е. положения конца ртутного столбика, числами. Во Флоренции короткое время (1657 - 1667) существовала Академия экспериментальных исследований. Флорентийские академики превратили жидкостный термометр (рис. 7) в надежный прибор. Большинство из них в прошлом были учениками Галилея.

Рис. 6. Образец флорентийского термометра. В 17 в. ученые начали измерять температуру термометром, а многие люди украшали термометром свои жилища. Отсюда старания стеклодувов создать возможно более нарядные термометры, порой в ущерб их прямому назначению.
Флорентийские академики открыли, что в смеси воды со льдом один и тот же термометр всегда показывает одно и то же. Отсюда и возникло понятие о состояниях (точках) с постоянной температурой. Температура смеси не зависит от соотношения количеств воды и льда. При точности измерений температуры в 17 в. нельзя было заметить, изменяется ли температура смеси при изменении барометрического давления. Открытие второй постоянной точки - температуры кипения воды - потребовало гораздо больше времени. Температура кипения заметным образом зависит от барометрического давления. В 1724 г. это окончательно установил стеклодув Г. Д. Фаренгейт (1686 - 1736).
Научные приборы, научная аппаратура 17 и первой половины 18 в. были почти исключительно стеклянными. Поэтому уровень стекольной промышленности и искусство стеклодувов существенно влияли на достижения исследователей. Фаренгейт участвовал в важных опытах (1732), которые привели Блека (1760) к понятию теплоемкости.
Открытие двух постоянных точек использовали, чтобы сопоставлять уровень жидкости в трубке термометра с температурой тела. Изменение длины жидкостного столбика при повышении температуры от точки плавления льда до точки кипения воды (при давлении в одну атмосферу) делили на произвольное число равных частей - градусов. Деления продолжили и ниже, и выше двух постоянных точек. Этот принцип построения термометрической шкалы с успехом применил Фаренгейт. Окончательное торжество принципа (1742) связано с именем А. Цельсия (1701 - 1744). Он обозначил температуру плавления льда через 100 градусов, температуру кипения воды - через нуль градусов и ввел во всеобщее применение стоградусную шкалу температур. Но вскоре (1750) эти обозначения поменяли местами. Этой шкалой пользуются уже более 200 лет почти повсюду в мире.
Газовый термометр постоянного объема. Труднее всего для начинающих (увы! не только для них) понять, в чем же смысл чисел, которыми выражают температуры. Как часто смешивают законы природы с допущениями, принятыми для построения температурной шкалы!
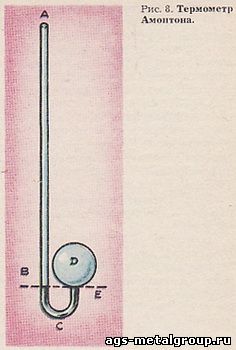
Расскажем, как превратили газовый термоскоп постоянного объема в термометр. Ж. Амонтон (1663 - 1705) в связи с работой огненной машины (она приводила в движение его мельницу) заинтересовался вопросом, на какую долю возрастает давление воздуха при его нагревании (1699). Решение этой задачи навело Амонтона на мысль (1702) судить об изменениях температуры по изменениям давления воздуха при (практически) постоянном объеме. В термоскопе Амонтона (рис. 8) ртуть отсекала воздух в шаре (его диаметр примерно 8 см) от внешнего воздуха. Она находилась в нижней части шара и в узкой трубке АВСЕ (ее диаметр примерно 1 мм). При таких размерах термоскопа давление воздуха в шаре изменяется, даже значительно, при (практически) постоянном объеме воздуха. Современные газовые термометры - термометры постоянного объема. Прибор Амонтона был их первым образцом, первым воплощением удачной идеи.
Дальнейшее изложение основано на современных представлениях о температуре. Современную температурную шкалу. термодинамическую шкалу температур, строят не по двум постоянным точкам, а по одной. Температурная шкала, предложенная Амонтоном, тоже была основана на одной постоянной точке - точке кипения воды. Но Амонтон еще не знал, что температура кипения воды зависит от давления. Постоянная точка в современной шкале не температура кипения воды, не температура плавления льда под атмосферным давлением, а тройная точка воды. В этой точке находятся в равновесии лед, вода и водяной пар. Давление водяного пара (это насыщенный пар) равно в тройной точке 4,579 мм рт. ст. Температуре тройной точки воды приписали число 273,16 точно. Почему именно такое число, почему не другое, почему не целое? Можно и другое, можно и целое, но желали свести до минимума разрыв между новой шкалой и прежними шкалами. Других причин не было. О числе 273,16 раньше говорили 273,16 градусов Кельвина и писали 273,16°К. Сейчас вместо «градус Кельвина» говорят «Кельвин» и пишут 273,16 К.
Как же выразить числами прочие температуры? Температура - интенсивная величина. Закон сложения к ней неприменим. Непосредственное численное сравнение двух температур невозможно. Сравнивать температуры надо через экстенсивную величину, которая изменяется с температурой. В качестве такой величины в современных газовых термометрах постоянного объема используют давление. Если говорить точно, то давление - это интенсивная величина. Но давление равно силе, деленной на площадь, равно частному от деления двух экстенсивных величин. Это и делает возможным непосредственное численное сравнение двух давлений. Таких интенсивных величин, произведенных из экстенсивных величин, в термодинамике много. Например, общий объем и масса - экстенсивные величины. Но частное от деления общего объема системы на ее массу - удельный объем - есть интенсивная величина. Методы измерения экстенсивных величин вполне применимы для измерения таких производных интенсивных величин.
Наполним термоскоп Амонтона гелием при малой его плотности, как им и наполняют современные газовые термометры постоянного объема. Малая плотность гелия делает его поведение простым и избавляет от введения поправок при измерении температуры. Установим термическое равновесие между термоскопом Амонтона и смесью льда, воды и водяного пара в тройной точке. Затем измерим давление гелия.
Установим термическое равновесие между термоскопом Амонтона и системой с другой температурой. Температура системы определяется состоянием системы. Например, система - кипящая под давлением в одну атмосферу вода; система - азот при заданных его давлении и плотности. Измерим давление гелия при новом термическом равновесии. Вычислим отношение двух давлений при двух рассмотренных термических равновесиях. Это отношение не зависит от выбора единицы, которой измеряют давление. Отношение при малой плотности гелия не зависит от плотности гелия в термоскопе, а зависит только от температур обеих систем. Эти температуры определяются состояниями обеих систем, присущи обоим состояниям. Тем не менее непосредственное численное сравнение двух температур исключено. Не существует поэтому определенной математической зависимости между отношением давлений при двух термических равновесиях и температурами двух систем, что участвуют в этих равновесиях. Искать математическую зависимость бессмысленно, ее выбирают по соображениям целесообразности и удобства. Плодотворным оказалось допущение: (давление гелия при постоянном объеме при термическом равновесии с какой-нибудь системой) : (давление гелия при том же постоянном объеме при термическом равновесии со смесью льда, воды и водяного пара в тройной точке) = (численное значение температуры первой системы) : (численное значение температуры в тройной точке воды).................... (8)
Закона природы уравнение (8) не выражает. Уравнение (8) - удобное допущение, одно из бесчисленного их множества.
В опытах Бойля давление и объем были измерены независимо друг от друга. Давление сравнивали со значением давления, принятым за единицу; объем сравнивали со значением объема, принятым за единицу. Обратная пропорциональность между давлением газа и его объемом (при постоянной температуре) - закон природы!
Допущение, выраженное уравнением (8), позволяет находить численные значения температуры для любых систем в любых состояниях. Газовый термоскоп постоянного объема стал газовым термометром постоянного объема.
Используя уравнение (8), получают, что температура плавления льда под давлением в одну атмосферу равна (273,1500 +-0,0002) К, а температура кипения воды под давлением в одну атмосферу равна 373,148 К. Разность между температурой кипения воды под давлением в одну атмосферу и температурой плавления льда под тем же давлением равна 99,998 К, а не точно сто, как в шкале Цельсия.
Квазистатическое изменение температуры. На примере механического равновесия известно, как надо проводить процесс, чтобы система оставалась в состоянии внутреннего механического равновесия. Можно сообразить, по аналогии, как надо поступить, чтобы на каждой стадии процесса сохранилось состояние внутреннего термического равновесия. Процесс надо проводить квазистатически: на каждой его стадии внешняя температура должна очень мало (бесконечно мало) отличаться от температуры системы. И в случае изменения температуры сохранение внешнего термического равновесия - необходимое и достаточное условие для сохранения незаторможенного внутреннего термического равновесия при процессе.
Одного источника работы достаточно, чтобы создать любое внешнее давление на границы системы. Но одного термостата, по самому смыслу этого слова, никак не хватит для квазистатического изменения температуры. Для этой цели необходим набор из бесконечно большого числа термостатов. Температура каждого из термостатов отличается от температур двух его ближайших соседей, снизу и сверху, на бесконечно малую величину. Для квазистатического изменения температуры приводят систему в тепловой контакт последовательно с каждым из термостатов, и она приходит в состояние термического равновесия, внешнего и внутреннего. Меняя таким образом температуру системы при каждом контакте на очень малую величину, в результате квазистатически изменяют температуру на конечную величину.
Система находится в состоянии незаторможенного внутреннего термического равновесия.
Приведем ее в тепловой контакт с термостатом. Температура его отличается на конечную величину от температуры системы.
В результате система придет в состояние внешнего термического равновесия с термостатом и в состояние (нового) незаторможенного внутреннего термического равновесия.
Но система перешла из одного состояния незаторможенного внутреннего термического равновесия в другое состояние тоже незаторможенного внутреннего термического равновесия уже нестатическим путем.
Причиной нестатического перехода было отсутствие внешнего термического равновесия на каждой стадии процесса. В дальнейшем читатели убедятся, как для термодинамики важно уметь квазистатически изменять температуру.
