Обратимые и необратимые процессы. В начале и конце процесса известны состояния системы, положения груза, состояния источников теплоты. Надо по этим сведениям установить, был ли процесс квазистатический или нестатический. Можно попытаться решить задачу чисто опытным путем (опыты мысленные). Постараемся восстановить первоначальные состояния всех участников процесса. Можно, это разрешается, к восстановлению привлечь и другие системы, другие источники работы и теплоты. Обязательно, однако, требуется, чтобы после восстановления прежних участников процесса в их первоначальных состояниях привлеченные участники тоже не изменились. Попытку восстановления проводят квазистатически, иначе она неизбежно обречена на неудачу. При квазистатическом проведении процесса получают наибольшее и тратят наименьшее количество работы.
Пусть попытка восстановить начальные состояния всех участников (прежних, участвовавших в процессе, и привлеченных к восстановлению) удалась. Мы вправе сказать: система перешла из начального состояния в конечное квазистатически. Подчеркнем возможность восстановить повсюду первоначальные состояния и скажем: процесс был обратимым. Но если не удается восстановить повсюду первоначальные состояния, если мы уверены, что никакая попытка не может привести к успеху, мы скажем: процесс был нестатическим, процесс был необратимым. Необратимость процесса не означает, что нельзя восстановить первоначальные состояния самих участников процесса. Это можно. Нельзя восстановить первоначальные состояния всех участников, привлеченных к восстановлению. Мы восстановим начальные состояния самих участников процесса и увидим: другой груз оказался на более низком уровне, чем груз был до привлечения, а один привлеченный источник теплоты получил теплоту. Это количество теплоты равно, по принципу эквивалентности, количеству работы при опускании привлеченного груза. Мы восстановим первоначальные состояния самих участников процесса и увидим: один привлеченный источник теплоты с более высокой температурой отдал некоторое количество теплоты, а другой привлеченный источник теплоты с более низкой температурой получил то же количество теплоты. И после нестатического процесса можно восстановить начальные состояния участников процесса, но надо уплатить компенсацию. Без нее восстановить начальные состояния после нестатического процесса нельзя, после квазистатического - можно.
У великого таджикского поэта и ученого Омара Хайяма (ок. 1040 - 1123) есть высказывание: «Движущийся Палец пишет и, написав, передвигается дальше; ни ваше благочестие, ни ум не завлекут его назад, чтобы вычеркнуть хоть половину строки; все ваши слезы не смоют ни одного слова из написанного». В свете второго начала можно вычеркнуть, можно смыть (в случае термодинамического процесса) все написанное, все строки, все слова, но при обязательном условии написать другие эквивалентные слова. Но в конечном счете Омар Хайям прав: раз написанное остается, меняется лишь текст, в лучшем случае на эквивалентный. Компенсацию нельзя ни вычеркнуть, ни смыть. В лучшем случае одну компенсацию можно заменить на другую, эквивалентную.
Изложенный способ выяснять, был ли процесс квазистатическим и обратимым или нестатическим и необратимым, все же не слишком достоверный. Если система сложна, если источников теплоты много, то всегда останутся сомнения, не просмотрели ли мы какой-нибудь удачной попытки восстановить начальные состояния всех участников процесса. Но термодинамика предлагает критерий (греческое слово kriterion - средство для решения). Он учитывает все возможные попытки восстановления. Это энтропийный критерий, уравнения (23), (23 а). Общая энтропия всех участников после квазистатического процесса не изменяется, после нестатического - возрастает.
Изменение общей энтропии всех участников процесса складывается из изменения энтропии источника работы (всегда нуль!), изменений энтропии источников теплоты (просто вычислить) и изменения энтропии системы. Чтобы вычислить изменение энтропии системы, надо перевести ее из начального состояния в конечное квазистатическим путем (любым, но квазистатическим!). Никто да не делит количество теплоты нестатического процесса на термодинамическую температуру системы! Опыт Гей-Люссака с расширением газа проходит в адиабатических условиях. Количество теплоты в опыте равно нулю. Количество приведенной теплоты тоже равно нулю. Но это - количество приведенной теплоты нестатического процесса, а ее нельзя приравнивать изменению энтропии системы. Чтобы вычислить изменение энтропии при изотермическом расширении газа, надо этот процесс провести квазистатически. При квазистатическом изотермическом расширении газа он производит работу над источником работы и получает от источника теплоты (с той же температурой, что и газ) количество теплоты, равное (газ малой плотности) количеству произведенной работы. Это количество теплоты делим на термодинамическую температуру и получаем правильное значение энтропии при изотермическом расширении газа. Приведенная теплота квазистатического процесса - величина положительная: при изотермическом расширении газа энтропия его увеличивается. В опыте Гей-Люссака источник теплоты не получил и не отдал теплоты. Изменение энтропии источника равно нулю Изменение общей энтропии всех участников больше нуля. Расширение газа в опыте Гей-Люссака - процесс нестатический, необратимый.
При адиабатическом процессе энтропия системы только тогда остается постоянной, когда процесс квазистатический. Квазистатический адиабатический процесс называют изэнтропическим процессом. Две адиабатические стадии в квазистатическом цикле Карно- это изэнтропические стадии, сокращенно - изэнтропы.
Развитие термодинамических систем. Квазистатический процесс - это ряд (бесконечно) медленно сменяющихся равновесных состояний системы. Можно только условно говорить о направлении квазистатического процесса. Система, источник работы и источники теплоты никуда не направляются: равновесие - состояние, а не процесс. Квазистатический процесс не идет, его ведут. Направление квазистатического процесса создается при (бесконечно) малом нарушении равновесия между системой, с одной стороны, и источником работы и источниками теплоты, с другой. Изменение общей энтропии всех участников квазистатического процесса равно нулю. Нуль - свидетельство отсутствия направления, отсутствия развития. Все, что произошло, можно стереть, можно восстановить начальные состояния всех участников процесса без всякой компенсации.
Чтобы процесс был направленным, он не может быть квазистатическим.
Ему остается быть нестатическим.
Протекание нестатического процесса всегда сопровождается возрастанием общей энтропии всех его участников, критерии (23), (23 а). Поэтому протекание направленного процесса тоже сопровождается возрастанием общей энтропии всех участников процесса. Нестатического процесса, протекание которого сопровождалось бы убылью общей энтропии, быть не может. Процесс всегда направляется таким образом, чтобы общая энтропия всех участников процесса возрастала. Критерии (23), (23 а) нестатичности (необратимости) процесса одновременно являются и критериями направленности процесса.
Величина, которая входит в критерии (23), (23 а),- общая энтропия всех участников процесса - есть свойство, свойство системы, свойство источников теплоты. (Источник работы лишен этого свойства.) Поэтому приращение общей энтропии определяется только начальным и конечным состояниями всех участников процесса, но не самим процессом. По начальным и конечным состояниям всех участников процесса можно установить, пойдет или не пойдет процесс в направлении от начальных состояний к конечным. Знак приращения общей энтропии все решит. Знак «плюс» - процесс пойдет из начальных состояний в конечные. Знак «минус» - процесс пойдет из конечных состояний в начальные. Процесс идет сам. Сам в том смысле, что в процессе участвуют только отобранные системы. Весь прочий мир в процессе не участвует и поэтому не изменяется. Нестатический процесс может идти сам и только таким образом, чтобы общая энтропия всех участников процесса возрастала. Нестатический процесс не может идти сам в том направлении, в каком общая энтропия всех участников процесса уменьшается. О направлении процесса судят по изменению общей энтропии всех участников процесса. Но направленный, нестатический процесс происходит в системе, а не в источниках теплоты или источнике работы. Изолируем полностью систему от источников теплоты и источника работы. Если направленный, нестатический процесс был возможен до изоляции системы, то этот же процесс остается возможным и после ее изоляции. Система, которая не находится в состоянии равновесия, способна развиваться. «Второе начало термодинамики выражает необходимую эволюцию, неизменный порядок в последовательности явлений. Когда система развивается, не подвергаясь внешнему воздействию, она никогда не проходит повторно через предшествующее состояние: явления не повторяются» (Ж. Перрен - выдающийся французский физик, 1870 - 1942).
Критерием развития является изменение общей энтропии. Этот критерий можно назвать принципом увеличения энтропии ~греческое слово 1горе - превращение). Клаузиус добавил к этому слову еще две начальные буквы «э» и «н», чтобы слово «энтропия» стало подобно слову энергия». «Обе величины, названные этими словами, настолько близки друг к другу по их физической значимости, что известное сходство в названиях кажется мне целесообразным» (Р. Клаузиус).
Равновесие термодинамических систем. Участники процесса: система - переохлажденная вода при - 2'С; источник теплоты с той же температурой; источник работы. Система помещена в цилиндр, герметически закрытый подвижным поршнем. Она находится в состоянии внутреннего механического равновесия и в состоянии внешнего механического равновесия с источником работы. Давление равно 1 атм. Система находится в состоянии внутреннего термического равновесия и в состоянии внешнего термического равновесия с источником теплоты.
Система способна к химическому превращению: переохлажденная вода может самопроизвольно превратиться в лед. Переохлажденная вода существует, потому что химическое превращение заторможено. Торможение можно снять. Достаточно внести в воду небольшой, исчезающе малый по сравнению с системой, кристаллик льда (зародыш). Устранение торможения не требует термодинамических затрат, достаточно прикосновения. Торможение снято, и переохлажденная вода превращается при постоянных давлении и температуре в лед. Источник теплоты получает теплоту, ее количество равно скрытой теплоте замерзания воды. Энтропия источника теплоты возрастает на количество полученной приведенной теплоты. Но процесс в системе нестатический, а по теплоте такого процесса нельзя вычислять изменение энтропии. Переход переохлажденной воды в лед надо провести квазистатически. Превращение переохлажденной воды в лед - самопроизвольный процесс. Поэтому при квазистатическом проведении процесса система производит химическую работу над источником работы. Тогда, по уравнению (12), система отдает при квазистатическом процессе меньшее количество теплоты, чем при нестатическом (при нестатическом процессе химической работы нет). Энтропия системы понижается меньше, чем увеличивается энтропия источника теплоты. Общая энтропия при самопроизвольном процессе возрастает. Так и должно быть по уравнениям (23), (23 а). Обстановка процесса такова, что возрастание общей энтропии прямо пропорционально количеству превратившейся в лед переохлажденной воды. Процесс будет продолжаться до полного замерзания воды.
Изменим теперь условия опыта: вода при 2С; источник теплоты с той же температурой; источник работы. Может ли при этих условиях вода самопроизвольно превращаться в лед? Если самопроизвольный процесс возможен, то общая энтропия должна увеличиваться. Энтропия источника теплоты увеличится на количество приведенной теплоты, полученной источником теплоты. Но это количество приведенной теплоты, с обратным знаком, не равно уменьшению энтропии системы. Она совершает нестатический процесс. Воду при 2 С надо квазистатически перевести в лед при той же температуре. Но у льда при 2'С большее давление насыщенного пара (перегретый лед), чем у воды при 2'С. Для квазистатического превращения воды в перегретый лед источник работы должен совершить работу над системой. Тогда количество теплоты, которую отдает система при квазистатическом процессе, больше, чем количество теплоты, которую система отдает при нестатическом процессе. Уменьшение энтропии системы превосходит увеличение энтропии источника теплоты. Общая энтропия уменьшается. Самопроизвольное образование перегретого льда из воды исключено. Возможен обратный процесс: таяние перегретого льда. Процесс прекратится, когда растает весь лед.
При 0 С и атмосферном давлении вода и лед находятся в химическом равновесии. Всякий процесс при условиях равновесия есть квазистатический процесс. По приведенной теплоте плавления (замерзания) можно измерять не только изменение энтропии источника теплоты, но и изменение энтропии системы. Изменение энтропии источника теплоты гасится изменением энтропии системы. Общая энтропия не изменяется. Энтропийный принцип снова дал правильный ответ.
Система вода - лед находится в состоянии незаторможенного внутреннего механического равновесия и в состоянии внешнего механического равновесия (давление 1 атм), а также в состоянии незаторможенного внутреннего термического равновесия и в состоянии внешнего термического равновесия (температура 0 С), и в состоянии незаторможенного внутреннего химического равновесия. Система останется в состоянии равновесия, если, ничего не изменяя в системе, отсечь ее от источников теплоты и источника работы, изолировать систему. Самопроизвольный процесс в рассматриваемой изолированной системе исключен. Он повлек бы за собой уменьшение энтропии изолированной системы. Но энтропия изолированной системы одновременно есть и общая энтропия.
Итак, развитие системы сопровождается ростом общей энтропии. (Источники теплоты и источник работы выбраны так, что у них самопроизвольное развитие исключено.) Развитие идет до тех пор, пока общая энтропия может увеличиваться. Такое (предполагаемое) развитие, которое в дальнейшем повлечет за собой уменьшение общей энтропии, исключается. Развитие системы конечных размеров не может продолжаться до бесконечности. Развитие закончится состоянием равновесия. Общая энтропия приобретает наибольшее значение (при данных условиях развития).
Если развитие системы уподобить ее жизни, то равновесие системы - это ее смерть. «Второе начало предвещает смерть от тюремного заключения. Единственный способ избежать ее - устранить заключение».

Рис. 18. Вода, падающая с гор, измельчает их, превращает в валуны, гальку, песок. В. Томсон (Кельвин) описал фантастический термодинамический процесс. Пузырьки пены, лопающиеся у подножия водопада, соединяются и входят в воду. Теплота, которая выделилась при падении воды, при трении кусков горной породы друг о друга, сейчас тратится на подъем воды. Из песка снова образуется галька, из нее валуны, из валунов горы. Все это, конечно, термодинамическая галлюцинация. Второе начало предвещает смерть от тюремного заключения. Единственный способ избежать смерти системы - устранить заключение. 30 миллионов лет назад Красного моря не было, Аравийский полуостров был соединен с Африкой. Но в этом месте образовалась трещина. Юг азиатского континента стал перемещаться на северо-восток, и при сжатии возникли Гималайские горы. На рисунке землетрясение восстановило горы.
Жалобы начинающих на энтропию. Начинающие изучать термодинамику обычно жалуются, что понятие энтропии не является для них наглядным. Выясним поэтому, что мы считаем наглядным. В Толковом словаре русского языка под редакцией профессора Д. Н. Ушакова прочтем: «Наглядный. Такой, что можно непосредственно созерцать и понимать, доступный и убедительный для непосредственного наблюдения, понимания».
В смысле данного определения энтропия наглядной не является и не может являться.
Что, по мнению читателей, более наглядно - лошадь или тепловая машина? В одной книге по истории философии приводится рассказ, возможно анекдотический.
Когда в Германии появились первые паровозы, сельский пастор пояснял пораженным крестьянам устройство и действие паровой машины. Закончил пастор объяснение вопросом: «Всё поняли?» - «Всё поняли! Но где же там внутри находится лошадь?» «Лошадь же, - язвит автор книги, - в объяснении не нуждается!» Лошадь несравненно более сложна, чем тепловая машина. Наука пыталась представить лошадь как тепловую машину, а не тепловую машину как лошадь. Крестьяне с детства знают лошадь, и она для них «наглядна». Для теплотехников «наглядна» тепловая машина, а не лошадь, Наглядность не одинакова для всех, она зависит от уровня знаний. В. Томсон как-то на лекции произнес слово «математик». Прервав лекцию, Томсон спросил студентов: «Знаете ли вы, кто такой математик?» Томсон подошел к доске и написал:
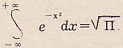
Затем Томсон поставил палец на формулу, которую написал, повернулся к студентам и сказал: «Математик - тот, для кого это так же очевидно, как для вас дважды два - четыре». Авторы признаются, что под определение математика, данное В. Томсоном, они не подходят. Может быть, математики найдутся среди читателей?
Понять энтропию - это знать ее происхождение, знать связи ее с другими понятиями, уметь применять энтропию на практике.
Энтропия и вероятность. Чем больше связей знают читатели между энтропией и другими понятиями, тем лучше они усваивают, что такое энтропия.
В приборе Гей-Люссака в одном шаре находится газ (при малой его плотности). Другой шар эвакуирован. Открывают кран на трубке, соединяющей оба шара. Результат опыта известен: газ равномерно заполняет оба шара. Температура всего газа та же, что и до расширения. При самопроизвольном изотермическом расширении газа увеличивается его энтропия (процесс адиабатический, и энтропия источников теплоты не изменяется). Самопроизвольное сжатие газа в приборе Гей-Люссака до прежнего объема исключено-. энтропия уменьшилась бы.
Газ, читатели знают, состоит из молекул (некоторые газы состоят из атомов). В газе малой плотности одна молекула воздействует на другую только в короткие моменты столкновений между молекулами. Большую же часть времени молекула свободно двигается по объему, предоставленному всему газу.
Предположим, что физик может отличить одну молекулу от других. Физика спрашивают, в каком шаре находится выбранная молекула, подчеркнутая красным, как говорил Эйнштейн. (Объемы шаров, чтобы упростить рассуждения, равны.) Физик ответит: до наблюдения не знаю. Он сошлется на то, что на выбранную молекулу (как и на все остальные) ничего не воздействует. Выбранная молекула (как и все остальные) никак не предпочитает один шар другому. Объемы шаров равны. Поэтому и физик не может предпочесть один шар другому. На техническом языке, вероятность нахождения выбранной молекулы в любом из шаров равна половине. Сумма вероятностей равна единице (половина плюс половина), равна достоверности. В каком-нибудь из двух шаров выбранная молекула обязательно находится.
Физику дальше ставят как будто совсем неразрешимый вопрос: в каком из шаров находятся все молекулы газа? На вопрос, где находится одна выбранная молекула, физик не мог ответить. Где же ему ответить на второй вопрос?! Ведь при 0'С и 1 атм в 1 см³ газа находится 2,7х1019 молекул. [Для сопоставления: пять миллиардов лет (возраст Земли) - 1,6х1017 секунд.] Физик, однако, с полной уверенностью ответит: ни в одном из шаров не содержатся все молекулы газа. Молекулы газа равномерно распределены между обоими шарами. Во всяком случае, отклонение от равномерного распределения при значительном объеме шаров, значит, и при большом числе молекул крайне мало, и этим отклонением можно спокойно пренебречь.
Откуда у физика такая уверенность? Из подсчета вероятностей. Именно потому, что для каждой молекулы вероятность находиться в том или другом шаре равна половине, все молекулы не могут находиться в одном только шаре. Вероятность такого случая тем меньше, чем больше число молекул. При том числе молекул, с каким обычно имеют дело в термодинамике, вероятность скопления всех молекул в одном только шаре чрезвычайно мала. Выдающийся французский математик Э. Борель (1871 - 1956) писал: «Я пришел к выводу, что не следует бояться применить слово достоверность для обозначения вероятности, которая отличается от единицы на достаточно малую величину». Статистический закон для большого числа молекул пробил себе дорогу через случайности для отдельной молекулы.
Приведенный пример свидетельствует, что существует связь между возрастанием энтропии в опыте Гей-Люссака и вероятностью распределения га г между обоими шарами. Обобщая, можно сказать: при самопроизвольном процессе система переходит из менее вероятного состояния в более вероятное.
